Конференц-залы научных институтов сегодня полны ученых новой породы — психонейроиммунологов. Эти люди зарабатывают на жизнь исследованиями, основанными на том невероятном факте, что происходящее в нашей голове может влиять на работу нашей иммунной системы. Когда-то считалось, что две эти сферы никак между собой не связаны — иммунная система уничтожает бактерии, продуцирует антитела, охотится на опухоли; мозг помогает нам танцевать, изобретать колесо и смотреть любимые телесериалы. Но идея о независимости иммунной и нервной систем оказалась ошибочной. Автономная нервная система пронизывает нервами ткани организма, которые формируют или хранят клетки иммунной системы. Затем эти клетки поступают в кровь. Кроме того, ткани иммунной
системы, оказывается, чувствительны (то есть обладают рецепторами) ко всем тем интересным гормонам, которые вырабатываются гипофизом по команде мозга. Поэтому, как оказалось, мозг постоянно сует свой нос в дела иммунной системы.
Доказательства влияния мозга на иммунную систему начали появляться как минимум 100 лет назад начиная с первой демонстрации: если перед носом человека, страдающего аллергией на розы, помахать искусственной розой (при условии, что он не знает, что роза фальшивая), у него случится аллергическая реакция. А вот очаровательная и более свежая демонстрация того, что мозг влияет на иммунную систему: возьмем две группы профессиональных актеров. Попросим первую группу целый день репетировать мрачную, депрессивную сцену, а вторую — оптимистичный, радостный этюд. У актеров из первой группы ослабеет реакция иммунной системы, а у актеров второй группы она усилится. (Как вы думаете, где было проведено это исследование? Конечно же, в Калифорнийском университете в Лос-Анджелесе.) Но наиболее явно на связь между мозгом и иммунной системой указало исследование, основанное на парадигме, получившей название «условное подавление иммунитета». Введите животному препарат, подавляющий иммунную систему. После этого проведите эксперименты в стиле Павлова с «условными стимулами», например давайте животному ароматизированный напиток, который оно может связать с подавляющим иммунитет препаратом. Несколько дней спустя дайте животному только условный стимул, вызывающий реакцию, — и иммунитет упадет. В 1982 году был опубликован отчет об эксперименте, основанном на одном из вариантов этой парадигмы и проведенном двумя новаторами в этой области, Робертом Адером и Николасом Коэном из Рочестерского университета. Результаты ошеломили ученых. В экспериментах на мышах животные неожиданно начали болеть из-за избыточной активности иммунной системы. Обычно болезнь контролируют,
давая мышам иммунодепрессанты. Адер и Коэн показали, что при использовании техники обусловливания препарат можно заменить условным стимулом — и это оказывает влияние на иммунитет животных в такой степени, что может продлить им жизнь.
Подобные исследования убедили ученых, что существует прочная связь между нервной и иммунной системами. Вполне очевидно, что раз искусственная роза или вкус ароматизированного напитка могут изменить иммунную функцию, то стресс тоже может это делать. В первой части этой главы мы обсудим влияние стресса на иммунитет и чем оно может быть полезно в стрессовых ситуациях. Во второй части главы мы поговорим о том, может ли длительный стресс из-за хронического подавления иммунитета ослаблять способность организма бороться с инфекционными заболеваниями. Это очень интересный вопрос, и ответить на него можно лишь с большой осмотрительностью и множеством оговорок. Появляются доказательства того, что стрессогенное подавление иммунитета действительно может увеличивать риск развития некоторых заболеваний и их серьезность. Но эта связь, похоже, не очень выражена и ее важность часто преувеличивают.
Чтобы оценить современные достижения в этой сложной, но важной области знаний, нужно начать с азов — с того, как вообще работает иммунная система.
Как действует иммунная система
Основная задача иммунной системы — защищать организм от возбудителей инфекций, например от вирусов, бактерий, грибков и паразитов. Этот процесс невероятно сложен. С одной стороны, иммунная система должна различать нормальные клетки и клетки-агрессоры — на жаргоне иммунологов, отличать «своих» от «чужих». Каким-то образом иммунная система помнит, как выглядит каждая клетка в нашем теле, и атакует любые клетки, где нет нашей индивидуальной «клеточной подписи» (например, бактерии). Кроме того, сталкиваясь с новым захватчиком, иммунная система способна даже создавать иммунологическую «запись» о том, на что похож этот возбудитель инфекции. Это позволяет ей подготовиться к его вторжениям в будущем. На этой способности основан принцип действия вакцинации: нам вводят небольшое количество ослабленного возбудителя инфекции, и это готовит иммунную систему к реальному нападению.
Иммунную защиту приводит в действие сложный комплекс клеток, циркулирующих в крови. Они называются лимфоцитами и моноцитами (все вместе иммунные клетки называются лейкоцитами; «циты» — это «клетки»). Есть два класса лимфоцитов: Т-клетки и В-клетки. И те и другие формируются в костном мозге, но Т-клетки мигрируют в тимус (вилочковую железу) и достигают зрелости уже там (поэтому они и называются «Т-клетками»). В-клетки вызревают в костном мозге. В-клетки производят преимущественно антитела. Существует несколько видов Т-клеток (Т-хелперы, Т-супрессоры, цитотоксичные Т-киллеры и т. д.).
Т-клетки и В-клетки атакуют возбудителей инфекции по-разному. Т-клетки создают клеточный иммунитет (рис. 25). Когда возбудитель инфекции вторгается в организм, его распознает моноцит, который называют макрофагом. Он сообщает о чуждой частице клетке Т-хелперу. Включается тревожная сирена, и в ответ на вторжение «чужака» Т-клетки начинают рассредоточиваться по организму. Эта система сигнализации приводит к активации и быстрому распространению цитотоксичных Т-киллеров. В соответствии со своим названием они атакуют возбудителей инфекции и уничтожают их. Кстати, вирус СПИДа убивает как раз Т-клетки иммунной системы.
В-клетки действуют иначе. Они поддерживают иммунитет путем создания антител (рис. 26). Если макрофаги и Т-хелперы начали действовать, они стимулируют распространение В-клеток. Основная задача В-клеток— дифференцировать и производить антитела— большие белки, распознающие те или иные особенности вторгшегося возбудителя инфекции (как правило, его специфический белок) и присоединяющиеся к нему. Такая избирательность очень важна — форма образующегося антитела точно «подходит» к форме того или иного отличительного признака захватчика, как ключ к замку. Таким образом, антитела присоединяются к клеткам возбудителя инфекции, блокируют их и готовят к уничтожению.
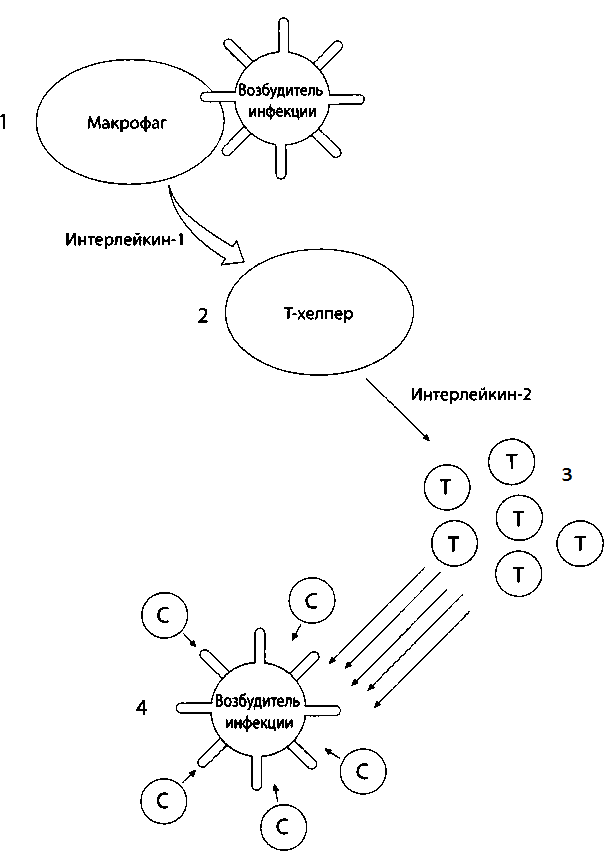
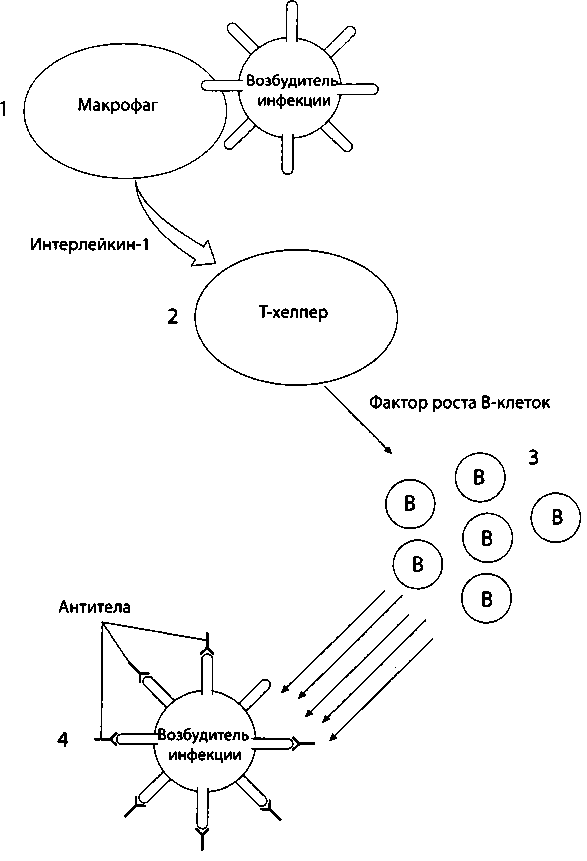
У иммунной системы есть еще один интересный аспект. Например, если разные части печени должны скоординировать ту или иную активность, у них есть преимущество соседства. Но клетки иммунной системы свободно циркулируют в крови. Чтобы тревожную иммунную сирену услышали во всех частях этой обширной системы, организм создал химические посредники С киоцтниы. )Они также циркулируют в крови и переносят сообщения между иммунными клетками разных типов. Например, когда макрофаги впервые распознают возбудителя инфекции, они вырабатывают посредника, который называется. Он побуждает Т-хелперы вырабатывать интерлейкин-2, который стимулирует рост Т-клеток (чтобы еще больше усложнить эту схему, есть как минимум штук пять дополнительных интерлейкинов с более узкими функциями). На фронте антител Т-клетки также вырабатывают фактор роста В-клеток. Другие классы посредников, например интерфероны, активируют разные типы лимфоцитов.
Процесс сортировки, когда иммунная система проводит разграничение между «своими» и «чужими», обычно довольно эффективен (хотя некоторые коварные тропические паразиты, например возбудители шистосомоза, научились обманывать иммунную систему, присваивая «подпись» собственных клеток организма). Иммунная система постоянно занята отделением «своих» от «чужих»: эритроциты — это мое. Брови — мои. Вирус — гадость, атакуем. Мышечные клетки — наши ребята… (рис. 27).

атакующей клетку опухоли
Но что, если в процессе иммунной сортировки случится сбой? Один очевидный тип ошибки — когда иммунная система не может распознать инфекцию-захватчика; конечно, это очень плохо. Не менее опасно, если иммунная система по ошибке признает вредным захватчиком того, кто на самом деле им не является. Например, какое-то совершенно безвредное вещество вызывает реакцию аварийного сигнала. Это может быть что-то съедобное, скажем арахис или моллюски, или что-то распыленное в воздухе и безвредное, вроде цветочной пыльцы. Но иммунная система по ошибке решила, что это не только «чужое», но и опасное, и начала активно с этим бороться. В таком случае возникает аллергия.
При втором типе гиперреакции иммунной системы за возбудителя инфекции принимается нормальная часть нашего собственного тела, и в результате она подвергается атаке. Когда иммунная система по ошибке нападает на нормальную часть тела, это может привести к самым разным и очень неприятным «аутоиммунным» заболеваниям. Например, при рассеянном склерозе нападению подвергается нервная система; при ювенильном диабете — клетки поджелудочной железы, обычно вырабатывающие инсулин. Как мы скоро увидим, стресс, как ни странно, влияет на течение аутоиммунных заболеваний.
До сих пор в этом кратком обзоре иммунной системы мы говорили о приобретенном иммунитете. Предположим, что вы в первый раз подвергаетесь действию некоего нового, опасного болезнетворного микроорганизма, назовем его патогеном X. У приобретенного иммунитета есть три особенности. Во-первых, он позволяет «научиться» атаковать именно патоген X с помощью специфических антител и иммунных клеток, способных распознавать именно этот патоген. Это дает важное преимущество: у нас появляется «маркер», на котором написано название патогена X. Во-вторых, для создания такого иммунитета нужно время: когда мы впервые сталкиваемся с патогеном X, нужно выяснить, какие антитела лучше всего ему соответствуют, и создать миллионы его копий. После этого мы можем выявлять и уничтожать патоген X в течение многих лет, и если эта специфическая защита уже есть, повторное воздействие патогена X будет только укреплять эту защиту.
Такой приобретенный иммунитет — весьма необычное изобретение, и он есть только у позвоночных животных. Но у нас есть еще и более простой, более древний механизм иммунной системы, такой же, как у живых существ совсем другого вида — у насекомых. Он называется врожденным иммунитетом. Он не предусматривает средств защиты, предназначенных специально для патогена X и особых антител, которые отличаются от тех, которые предназначены, скажем, для патогена Y. Но когда какой-то патоген поражает нас во второй раз, эта неспецифическая иммунная реакция тоже вступает в действие.
Такая общая иммунная реакция чаще всего возникает на переднем крае, где патоген завоевывает первый плацдарм, например в коже либо в ткани слизистой оболочки во рту или в носу. Как только это произошло, антитела, содержащиеся в слюне, атакуют любые «чужие» микробы. Это неспецифическая
реакция, не отличающая захватчиков друг от друга. Такие антитела вырабатываются в слизистой оболочке и покрывают ее антисептическим слоем. Кроме того, в месте инфекции расширяются капилляры и иммунные клетки могут свободно поступать сюда из крови, пропитывая область инфекции. Среди этих клеток— макрофаги, нейтрофилы и неспецифические клетки-киллеры, атакующие вредоносных микробов. Расширение капилляров также увеличивает приток жидкости, содержащей белки, препятствующие попаданию агрессивных микробов в кровь. Что происходит в результате? Белки борются с микробами, а жидкость вызывает отек. Так действует врожденная иммунная система: она вызывает воспаление¹. Итак, теперь у нас есть общее представление о том, как функционирует иммунная система. Пришло время рассмотреть, как стресс влияет на иммунитет. Естественно, этот процесс намного сложнее, чем может показаться.
________________________________________________
¹ Как мы только что сказали, врожденная иммунная реакция основана на том, что в зараженную область проникают белки. Среди белков, которые борются с микробами, есть один, о котором мы говорили в главе 3, С-реактивный белок крови. Думаю, вы помните, что клейкие частицы, например холестерин, создают атеросклеротические бляшки только в тех местах, где повреждены кровеносные сосуды. Поэтому степень повреждения и сила воспаления кровеносных сосудов — хороший прогностический фактор риска атеросклероза. С-реактивный белок, как мы уже знаем, — самый надежный индикатор такого воспаления.
Предыдущая – Женщины: расстройства цикла и аменорея | Следующая – Как стресс угнетает иммунную систему?





.jpg)
.jpg)
.jpg)
















